2024.04.22

Frontiers in Immunology期刊近期报道了克睿基因自主研发的CGC-602双抗分子,该分子为PD-1和IL-2双靶点(PD-1-IL-2v),其中IL-2v是“魔改”自野生型IL-2的变体。该变体在具备极佳安全性的同时,赋予了双抗分子二种T细胞激活机制,即同时具备阻断PD-1/L1实现激活,以及分子“顺式”的IL-2通路激活。双重的T细胞激活机制,使得CGC-602分子在临床前抗肿瘤模型中,表现出同剂量单药优于PD-1单抗的药效和良好的安全性。该分子目前在临床前阶段,克睿基因具有完全的知识产权。本文的通讯作者是克睿基因早期研发执行总监赵镭博士,唯一通讯单位是克睿基因。
Frontiers in Immunology

克睿基因发表文章截图
原文链接: https://doi.org/10.3389/fimmu.2024.1369376
研究背景
针对白介素-2(IL-2)为靶点的肿瘤免疫治疗药物开发,近年屡遭不顺,其可能的原因在于偏向性IL-2变体在偏向激动IL-2Rβ(CD122)或IL-2Rα(CD25)的同时,打破了原有的Teff与Treg的免疫平衡,导致过度激活NK或Treg的副作用。其分子机理在于这些IL-2变体都会单独结合IL-2Rβ或IL-2Rα,导致在很低的给药剂量下便产生了副作用,即便搭载了靶向PD-1或CD8的抗体组成双抗分子(如Roche的RO7284755),整体的给药剂量仍然较低,在临床或临床前的设计中需要联用靶向PD-L1的单抗才能体现药效。因此,如何改造IL-2分子,使其完全没有偏向性,既不单独结合IL-2Rβ或IL-2Rα,又保留对IL-2Rβγ复合物的结合活性,成为能够突破瓶颈的关键。具备这种功能的IL-2变体,有望搭配靶向T细胞表面受体(如PD-1)形成双抗分子,有效提高给药剂量并降低副作用,有望在单药药效中超越PD-1。
分子设计亮点
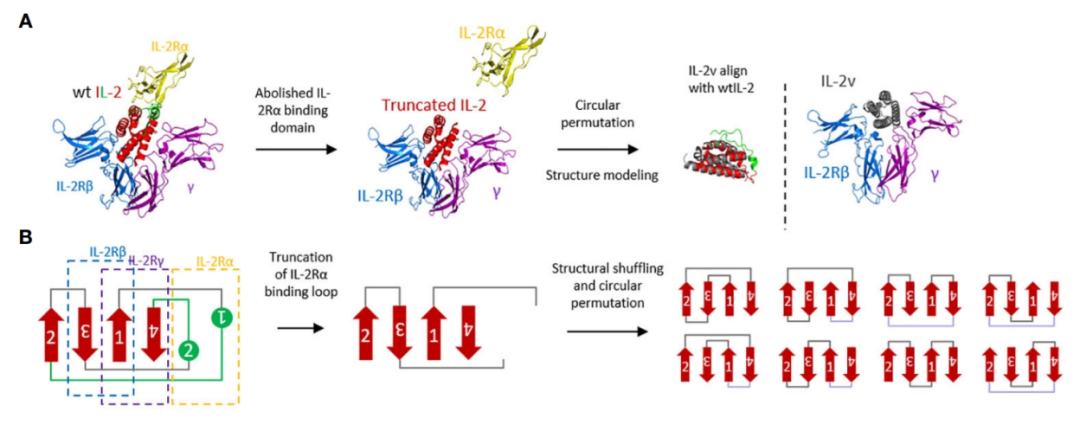
CGC-602分子中IL-2变体的“魔改”过程
为了实现上述功能,我们首先删除了IL-2中与IL-2Rα结合的区域,用于去除IL-2Rα的偏向性。接着,我们又将IL-2的剩余部分以刚性二级结构(α螺旋)为单位进行重组拼接,构建一个小文库,通过微调分子构象的方式去除IL-2Rβ的偏向性。最终筛选得到“魔改”后的IL-2的变体,具有不单独结合IL-2Rβ或IL-2Rα,同时对IL-2Rβγ复合物结合常数(Kd)与野生型IL-2近似的IL-2v。
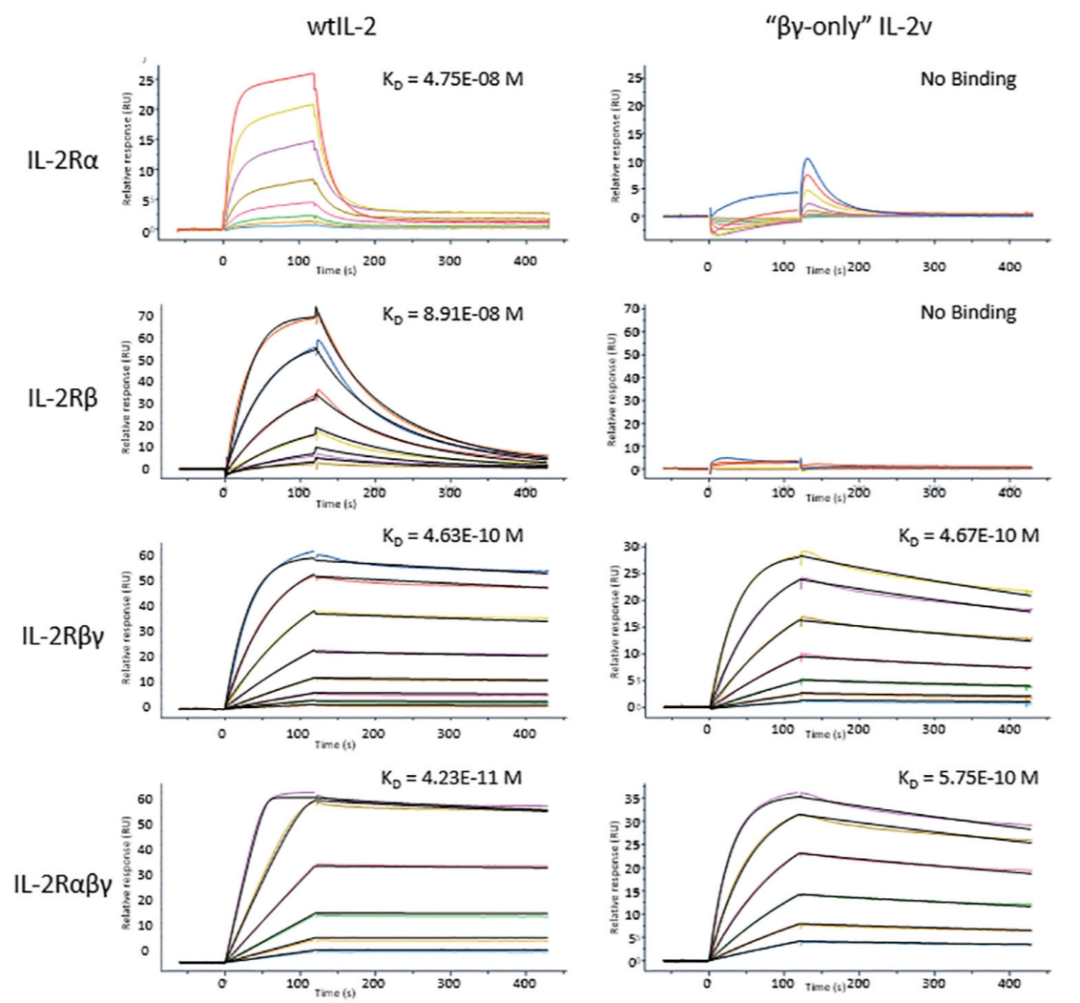
野生型IL-2与“魔改”后的IL-2v的受体结合模式比较
良好的抗肿瘤活性和安全性
在独特功能的IL-2v加持下,CGC-602双抗分子可以在PD-1单药同等剂量下,保持良好的安全性。在CDX小鼠荷瘤模型中,CGC-602与PD-1单抗头对头相比展现了更好的抗肿瘤活性。
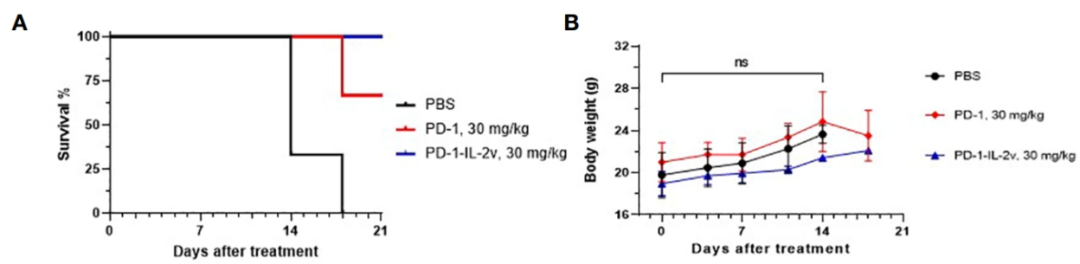
CGC-602在小鼠模型中体现良好的活性和安全性
总结
CGC-602分子具有既阻断PD-1/L1,又顺式激活PD-1阳性T细胞IL-2通路的功能,在应对PD-1耐药的场景中更有潜力。同时,该分子的设计和构建思路与传统突变的策略完全不同,在专利保护方面更有优势(PCT/CN2023/070898,专利权人:克睿基因)。
CGC-602分子是克睿基因研发团队在肿瘤免疫治疗和蛋白工程进化领域的一次源头创新尝试,目前该分子处于临床前PCC阶段。克睿基因正在积极寻找合作方以合作开发或对外授权的方式继续该项目研究。
克睿基因研发团队对肿瘤免疫细胞治疗和蛋白工程进化均有管线布局和平台搭建,如目前在IIT阶段的靶向CD70的CAR-NKT产品,及身兼多个国际合作项目的AAV衣壳定向进化平台VELPTM。克睿基因将一直秉承源头创新的理念,坚持国际化,对标国际一流研发团队,以细胞基因治疗惠及患者。
项目合作咨询:
lei.zhao@curegenetics.com
bd@curegenetics.com
克睿基因
克睿基因于2016年成立于苏州,是一家致力于开发针对实体瘤和常见遗传疾病细胞与基因治疗的临床阶段公司。通过我们创新的技术平台--包括通用型CAR-NKT平台AIMS CAR-NKT和独特的AAV技术平台VELPTM,克睿实现了差异化的管线布局,引领源头创新。通过国际化合作和对外授权,我们积极推动新药研发和商业化,旨在为全球未满足医疗需求的病人提供有效的治疗措施,致力于成为细胞与基因治疗领域的标杆。